-
반응공학 - 온도와 압력의 영향화공기사 필기/반응공학 2021. 3. 18. 01:37
1. 단일반응
1) 반응열
aA → bB + cC
위와 같은 화학반응이 있다고 할 때 반응열은 다음과 같다.

여기서 온도 T1에서의 반응열을 알고 있는 경우라면 온도 T2에서의 반응열을 계산할 수 있다.
온도 T2의 반응과정에서 흡수된 열 = 반응물의 온도를 T2에서 T1으로 변화시키는데 가한 열 + 온도 T1의 반응과정에서 흡수된 열 + 생성물의 온도를 T1에서 T2로 되돌리는데 가한 열
이것을 식으로 나타내면 다음과 같다.

이 식을 비열(Specific Heat)를 도입해서 정리하면 다음과 같은 식이 된다.

반응열 계산 식 2) 평형전화율
① 반트호프식(Van't Hoff eq)
평형상수에 의해 결정되는 평형조성은 온도에 따라 변화되며 열역학으로부터 변화율은 다음과 같이 주어진다.
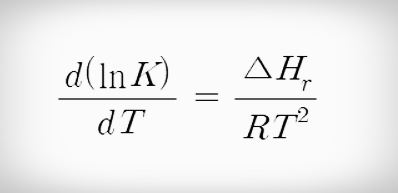
반트호프식(Van't Hoff eq) 이 식은 반트호프식(Van't Hoff eq)이라고 하며 K와 T를 적분하면 다음과 같은 식으로 정리할 수 있다.

② 온도가 평형전화율(Xae)에 미치는 영향
- 열역학에 의한 평형상수는 온도만의 함수이다. (압력, 불활성물질 존재 여부, 반응속도 등에는 영향 X)
- 반응물의 평형농도나 평형전화율은 압력, 불활성물질 등의 변수에 영향을 받는다.
- K ≫ 1 이면 완전한 전화가 가능하며 비가역반응으로 간주할 수 있다.
- K ≪ 1이면 반응이 많이 진행되지 않는다.
- 온도가 증가하면 흡열반응의 평형전화율은 증가하고, 발열반응의 평형전화율은 낮아진다.
- 기체반응에서 압력이 증가할 경우, 반응에 따른 몰수가 감소하면 전화율은 증가하고 몰수가 증가하면 전화율은 떨어진다.
2. 복합반응
1) 생성물의 분포와 온도
복합반응에서 경쟁적인 두 단계의 반응속도상수를 각각 k1, k2라고 할 때 이 두단계의 상대적 반응속도는 다음과 같다.

상대적 반응속도상수 여기서 온도가 상승할 때( T↑)
E1 > E2 이면 k1/k2는 증가
E1 < E2 이면 k1/k2는 감소
또한 다음과 같은 사실을 알 수 있다.
- 활성화 에너지가 큰 반응이 온도에 더 민감하다.
- 활성화 에너지가 크면 고온이 적합하고, 활성화 에너지가 작으면 저온이 적합하다.
2) 평행반응

첫번째 평행 반응 평행반응에서 R로 가는 단계는 촉진시키고, S로 가는 단계는 억제함으로써 k1/k2의 값이 커진다.
따라서
E1 > E2 이면 고온 사용
E1 < E2 이면 저온 사용
을 해야 한다.
3) 연속반응

비가역 연속 1차 반응 연속반응에서 K1/K2를 증가시키면 R(원하는 생성물)이 증가한다.
따라서
E1 > E2 이면 고온 사용
E1 < E2 이면 저온 사용
을 해야한다.
4) 연속평행반응

위와 같은 연속평행반응이 있다고 할 때 (E1 < E2 < E3 < E4, E5 = 0) 이라고 하면 다음과 같다.
① 원하는 생성물이 중간체 R 인 경우
: 1단계가 2단계, 3단계에 비해 빨라야 한다. E1<E2, E1<E3 이므로 저온과 플러그 흐름을 사용해야 한다.
② 원하는 생성물이 최종생성물 S인 경우
: 속도가 중요하므로 고온과 플러그 흐름을 사용해야 한다.
③ 원하는 생성물이 중간체 T인 경우
: 2단계가 1단계, 4단계에 비해 빨라야 한다. E2>E1, E2<E4 이므로 강온(Falling Temp)과 플러그흐름을 사용해야 한다.
④ 원하는 생성물이 중간체 U인 경우
: 1단계가 2단계보다 빠르고, 3단계가 5단계보다 빨라야 한다. E1<E2 이므로 승온(Rising Temp)과 플러그흐름을 사용해야 한다.
'화공기사 필기 > 반응공학' 카테고리의 다른 글
반응공학 - 촉매와 흡착현상 (0) 2021.03.18 반응공학 - 수율 (0) 2021.03.17 반응공학 - 평행반응과 연속반응 (2) 2021.03.17 반응공학 - 순환반응기 (0) 2021.03.16 반응공학 - 반응기의 크기 비교 (1) 2021.03.16