-
반응공학 - 화학반응공학화공기사 필기/반응공학 2021. 3. 3. 18:27
1. 화학반응의 분류
1) 균일계 : 단일상에서만 반응이 일어나는 경우
2) 불균일계 : 두 상 이상에서 반응이 진행되는 경우
3) 균일계와 불균일계의 분류가 불분명한 반응의 경우
① 효소 - 기질반응과 같은 생물학적 반응의 경우
② 연소하는 기체화염과 같이 화학반응속도가 급격히 빠른 경우
비촉매
촉매
균일계
대부분 기상반응
대부분 액상반응
불균일계
불꽃연소반응과 같은 빠른 반응
- 콜로이드상에서의 반응
- 효소와 미생물의 반응
- 석탄의 연소
- 광석의 배소
- 산 + 고체의 반응
- 기액 흡수
- 철광석의 환원
- NH3 합성
- 암모니아 산화 -> 질산 제조
- 원유의 크래킹
- 이산화황의 산화
2. 화학반응속도식
- 반응시간의 변화에 따라 반응물의 농도는 감소하고 생성물의 농도는 증가하는 현상을 이용하여 반응속도를 설명할 수 있다. A -> B 와 같은 화학반응이 있다고 가정하면 생성물 B의 생성속도는 다음과 같이 나타낼 수 있다.

생성물 B의 생성속도 만약 반응계 내의 용적(V)이 시간에 따라 변화하지 않는다고 하면 C=n/V 가 되고 다음과 같이 농도의 변화와 시간의 변화 함수로 나타낼 수 있다.

화학반응속도식 3. 온도에 의한 반응속도
- 일반적으로 화학반응시에 온도가 상승하면 분자운동이 증가되어 에너지가 활성화되면서 반응 분자 간 충돌에너지를 증가시켜 반응속도가 빨라진다. 하지만 복잡한 화학반응의 경우에는 온도가 증가하더라도 반응속도가 반드시 증가하지는 않다.
1) 아레니우스 식(Arrhenius equation)

아레니우스 식(Arrhenius equation) 아레니우스 식은 반응속도상수의 온도 의존성을 나타낸다. 아레니우스 식 양변에 자연로그 함수를 취해 정리하면 다음과 같다.

이 식을 통해서 Ea(활성화에너지)가 작고 T(절대온도)가 클 때 속도상수 k 값이 커지는 것을 알 수 있다. 또한, 이 식을 통해 다음과 같은 특징을 알 수 있다.
① T가 높아지면 lnk 도 높아진다.
② 높은 온도보다 낮은 온도에 더 예민하다.
③ 기울기(-Ea/R)가 가파를수록 Ea(활성화에너지)가 크다.
④ Ea가 클수록 k는 작아져서 반응속도가 느리다. (Ea가 작을수록 k는 커져서 반응속도가 빠르다.)
⑤ 저온일수록 k의 변화가 크다.
2) 아레니우스 변형 식
- 아레니우스 식을 변형하면 한 온도에서 k 값을 알 때 다른온도에서 k 값을 구할 수 있다.

(1) 번식에서 (2) 번식을 빼면 다음과 같은 식을 만들 수 있다.
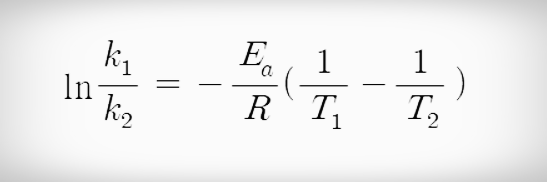
위 식을 이용하면 한 온도에서의 k 값을 알 때 다른온도의 k 값을 구할 수 있다.
'화공기사 필기 > 반응공학' 카테고리의 다른 글
반응공학 - 반응기의 크기 비교 (1) 2021.03.16 반응공학 - 흐름식 반응기(CSTR, PFR) (0) 2021.03.11 반응공학 - 회분식 반응기(변용반응기) (0) 2021.03.11 반응공학 - 회분식 반응기(정용 회분식) (0) 2021.03.05 반응공학 - 속도법칙 (0) 2021.03.04