-
반응공학 - 회분식 반응기(정용 회분식)화공기사 필기/반응공학 2021. 3. 5. 17:09
- 회분식 반응기 (Batch Reactor)는 반응물질을 반응하는 동안에 담아두는 일정한 용기를 말한다. 회분식 반응기에서는 반응물을 처음에 용기에 채우고 잘 혼합한 후 일정시간 동안 반응시킨다. 이 결과로 생긴 혼합물은 방출시킨다.
- 시간에 따라서 조성이 변하는 비정상 상태이다.
- 반응이 진행하는 동안 반응물, 생성물의 유입과 유출이 없다. (FA0 = FA = 0)
- 높은 전화율을 얻을 수 있다.
- 소규모 조업, 새로운 공정의 시험, 연속조작이 용이하지 않은 공정에 이용된다.
- 인건비가 비싸고 매회 품질이 균일하지 못하며 대규모 생산이 어렵다.
1. 전화율(Xa ; Conversion)
- 화학반응에서 물질의 전화율은 다음과 같은 식으로 나타낼 수 있다.

전화율(Conversion) 이때, Na는 시간 t에서 존재하는 몰수를 말하며 Na0는 시간 t = 0 에서 반응기 내에 존재하는 초기 몰수를 말한다.
반약 부피가 일정한 경우라면(V = constan) 위의 식은 다음과 같이 변형할 수 있다.

농도 식 CA 이 식을 미분한 뒤 정리하면 전화율에 대한 다음과 같은 식으로 나타낼 수 있다.
dXa = -(dCa/Ca0)
2. 정용 회분식 반응기(Constant Volume Batch Reactor)
- 정용 회분식 반응기는 부피가 일정한 회분식 반응기를 말한다. 이때 부피는 반응기의 부피를 말하는 것이 아닌 반응혼합물의 부피를 말한다. 일정한 부피의 용기 내에서 일어나는 모든 기상반응과 대부분의 액상반응은 이 경우에 해당한다.

정용 회분식 반응식 만약 반응이 기상반응(이상기체)이라면 반응속도 -ra는 다음과 같다.
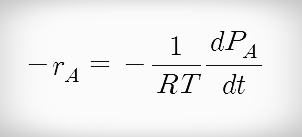
1) 비가역 단분자 0차 반응
- 0차 반응이란 반응속도가 물질의 농도에 관계가 없는 반응이다. 0차 반응의 속도식은 다음과 같다.

0차 반응 속도식 0차 반응의 속도식에서 Ca와 t에 대해 적분을 하면 반응시간(t)에 대한 식을 나타낼 수 있다.

- 반감기란 남아 있는 농도(Ca)가 처음 농도(Ca0)의 반이 되는데 걸리는 시간을 말한다. 즉 전화율(Xa)이 0.5가 될 때의 시간이므로 0차 반응에서의 반감기는 t = (Ca0/2k) 가 된다.
2) 비가역 단분자 1차 반응
A → R
- 비가역 1차 반응에서 반응속도식은 다음과 같다.
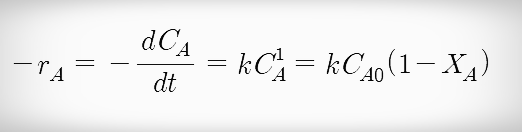
1차 반응 속도식 1차 반응의 속도식에서 Ca와 t에 대해 적분하면 반응시간(t)에 대한 식을 나타낼 수 있다.


왼쪽 : 반응시간과 농도 오른쪽 : 반응시간과 전화율 Ca = Cao(1-Xa) 의 관계식을 이용하면 왼쪽 식에서 오른쪽 식을 유도할 수 있다.
- 1차 반응에서 반감기는 0차 반응과 마찬가지로 Xa = 0.5일 때를 이용하여 구할 수 있다.
반감기 = t1/2 = (ln2/k)
3) 비가역 단분자 2차 반응
2A → R
- 비가역 2차 반응에서 속도식은 다음과 같다.

1차 반응과 마찬가지로 Ca와 t에 대해 적분하면 반응시간(t)에 대한 식을 나타낼 수 있다.

- 2차 반응에서 반감기는 Xa = 0.5일 때를 이용해서 구하면 다음과 같다.
반감기 = t1/2 = (1/kCa0)
4) 비가역 단분자 n차 반응
- 0,1,2차가 아닌 n차 반응일 때의 속도의 적분식과 반감기는 다음과 같다.


왼쪽 : 속도의 적분식 오른쪽 : n차 반응 반감기 '화공기사 필기 > 반응공학' 카테고리의 다른 글
반응공학 - 반응기의 크기 비교 (1) 2021.03.16 반응공학 - 흐름식 반응기(CSTR, PFR) (0) 2021.03.11 반응공학 - 회분식 반응기(변용반응기) (0) 2021.03.11 반응공학 - 속도법칙 (0) 2021.03.04 반응공학 - 화학반응공학 (0) 2021.03.03